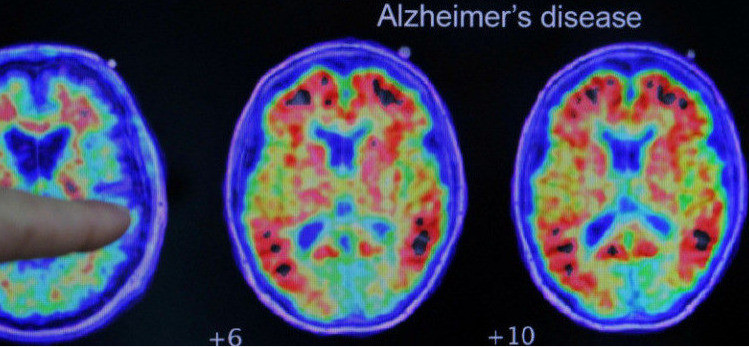
一項國際合作研究揭示了一種分子過程在阿茲海默症的發展中起著關鍵作用,這一發現為開發更有效的治療方法提供了新的希望。研究由德國海德堡大學的神經生物學家巴丁(Hilmar Bading)教授領導,並與中國山東大學的科學家合作完成。
根據科學網站《SciTechDaily》的報導,研究團隊利用阿茲海默症小鼠模型,證明了兩種蛋白質之間的有害互作會導致大腦神經細胞死亡,進而引發記憶力和認知能力的下降。這種有害的蛋白質組合由NMDA受體和TRPM4離子通道組成。NMDA受體位於細胞表面,包括突觸及其周圍區域,負責在神經細胞之間傳遞信號。雖然突觸NMDA受體的活性對於維持神經細胞健康和支持正常認知功能至關重要,但TRPM4的存在會導致突觸外NMDA受體產生毒性,形成所謂的「死亡複合物」,嚴重損傷神經元甚至導致其死亡。
研究發現,阿茲海默症小鼠體內的神經毒性NMDAR和TRPM4複合物含量遠高於健康小鼠。為此,研究團隊測試了一種名為FP802的新化合物。FP802能夠與TRPM4和NMDA受體相互作用的「TwinF」接觸面結合,阻斷這兩種蛋白質之間的物理互作,從而解體該複合物。FP802被描述為「TwinF接口抑制劑」,最初由巴丁教授及其同事在海德堡大學跨學科神經科學中心發現。
研究結果顯示,接受FP802治療的阿茲海默症小鼠,其疾病進展顯著減緩。巴丁強調,這種方法與以往的阿茲海默症治療策略有根本性的不同。傳統策略主要集中在大腦中的澱粉樣蛋白,而此實驗則針對NMDAR和TRPM4受體的複合物。研究團隊認為,FP802有望減緩甚至阻止阿茲海默症的進展。
然而,巴丁教授補充說,FP802距離臨床應用仍需進一步的研究。實現其在人體中的應用,還需要進行全面的藥理學開發、毒理學實驗和臨床研究。這項研究的發現為阿茲海默症的治療提供了新的方向,未來有望帶來更有效的治療方法。